전기화학 셀은 어떻게 구성되는지를 알아보자.
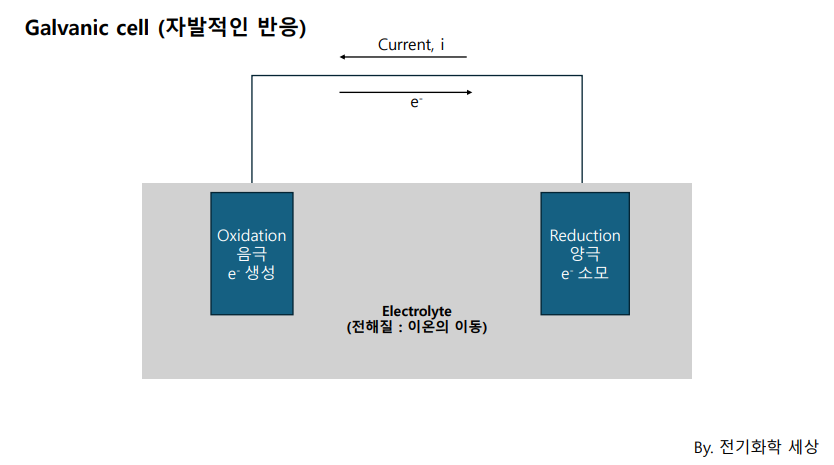
전기화학 셀 (Electrochemical cell)은 (최소한) 2개의 전극과 1개의 전해질로 구성된다.
산화반응이 일어나는 전극(Anode) , 환원반응이 일어나는 전극을 (Cathode), 이온이 이동하는 매체인 전해질 (Electrolyte)로 구성된다.
이때, "산화-환원 반응"은 한 물질에서 "전자"가 다른 물질로 이동하는 화학반응으로 한 원소가 산화(Oxidation)하면, 다른 원소는 반드시 환원(Reduction)되며 항상 동반되어 발생한다. 이를 Redox reaction이라고 한다.
여기서 산화 반응(Oxidation) 은 전자를 생성하는 반응이고, 환원 반응(Reduction)은 전자를 사용하는 반응이다.
산화에서 얻어진 전자는 환원반응으로 모두 사용하므로 전자는 독립적으로 안정하지 못하다는 특징을 갖고 있으며, 반응이 항상 동시에 일어나기 때문에 산화로 생성된 전자의 수 는 환원에서 사용한 전자의 수와 같다.
산화로 생성된 전자의 수 = 환원에서 사용한 전자의 수
Cu와 Zn로 구성된 전기화학 셀을 살펴보자.
Cu,Cu2+, Zn, Zn2+가 함께 존재할때, Cu는 반응하지 않고 용매속에 존재하는 Cu2+가 Zn는 Zn의 주변으로 안착하게 된다. 동시에 Zn2+는 떨어져 나가는데, 왜 이런 반응이 생성되는지를 살펴보자.
그 이유는 산화 반응과 환원반응을 살펴보면 쉽게 알 수 있다.
1) 반응기 내에 Cu,Cu2+, Zn, Zn2+가 함께 존재할 때, 반응이 어떻게 될까?
결론 : 자발적인 반응이 일어난다.
[가능한 산화반응]
Zn → Zn 2+ + 2e-
Cu → Cu 2+ + 2e-
[가능한 환원반응]
Zn 2+ + 2e- → Zn
Cu 2+ + 2e- → Cu
▼ Zn의 이온화경향이 큼
[최종 반응식]
Zn → Zn 2+ + 2e- (산화)
Cu 2+ + 2e- → Cu (환원)
----------------------------------
Zn + Cu 2+ → Zn 2+ + Cu
▼ 열역학적으로 안정하여 자발적 반응이 일어남
산화와 환원이 동시에 발생하여 바로 전자전달이 자발적인 반응이 발생하고, "열"이 발생한다.
2) 반응기 내에 Cu,Cu2+, Zn, Zn2+가 분리되어 존재할 때, 전류를 가해주면 어떤 반응이 일어날까?
결론 : Cu와 Zn에서 각각 산화와 환원이 발생한다.
[최종 반응식]
Zn → Zn 2+ + 2e- (산화)
Cu 2+ + 2e- → Cu (환원)
----------------------------------
Zn + Cu 2+ → Zn 2+ + Cu (Cu는 Cu2+ 이온이 전착하여 성장하고, Zn는 산화되어 감소된다.)
- 전류를 흘려주지 않을때는 반응 발생이 없다. 그 이유는 전자가 공급되지 않기 때문에 반응에 제한이 생긴다.
- 전류를 흘려주었을때는 전자의 이동으로 반응이 진행된다. 자발적으로 반응이 진행되고, 이때 화학반응과 함께 전기에너지도 생성된다.
Cu와 Zn 사이에 전자의 이동을 시켜줄 수 있는 도선의 여부에 따라 도선이 있는경우 Cu가 생성되며,
도선이 없는 경우 Zn 표면에 Cu가 석출되는 현상이 발생한다.
3) 전기화학 셀의 구동원리
갈바닉 셀은 자발적인 반응이 일어나는 셀이다.
음극, 양극, 전해질로 이루어져 있다고 하였을때, 음극에서는 환원이 발생하면서 전자를 잃게 되고 이 전자가 양극으로 이동하여 산화되며 전류를 발생시킨다.
이처럼 화학반응을 통해 전류가 발생하는 셀을 전기화학 셀이라고 한다.
'전기화학 및 이차전지' 카테고리의 다른 글
| #6. 리튬이온 이차전지에서 전극은 어떻게 구성되는가? (1) | 2024.02.03 |
|---|---|
| #5. 리튬이온 이차전지의 특성 (1) | 2024.01.30 |
| #4. 고출력 전지와 고에너지 전지의 차이점 (0) | 2024.01.29 |
| #3. 전압, 전류, 저항, 용량, 에너지, 출력의 의미 (0) | 2024.01.26 |
| #2. Cathode와 Anode 구별법 (1) | 2024.01.25 |
